Atom Teorisi Nedir?
Atom teorisi, fizik, kimya ve matematik unsurlarını birleştiren atomların ve maddenin doğasının bilimsel bir açıklamasıdır. Modern teoriye göre madde, atom adı verilen küçük parçacıklardan oluşur ve bunlar da atom altı parçacıklardan oluşur. Belirli bir elementin atomları birçok açıdan aynıdır ve diğer elementlerin atomlarından farklıdır. Atomlar, moleküller ve bileşikler oluşturmak için diğer atomlarla sabit oranlarda birleşir.
Teori, atomizm felsefesinden modern kuantum mekaniğine kadar zaman içinde gelişti. İşte atom teorisinin kısa bir tarihçesi:
Atom ve Atomizm
Atom teorisi, eski Hindistan ve Yunanistan'da felsefi bir kavram olarak ortaya çıkmıştır. "Atom" kelimesi, bölünmez anlamına gelen eski Yunanca atomos kelimesinden gelir. Atomizme göre, madde ayrık parçacıklardan oluşur. Bununla birlikte, teori madde için yapılan birçok açıklamadan biriydi ve ampirik verilere dayanmıyordu. MÖ beşinci yüzyılda Demokritos, maddenin atom adı verilen yok edilemez, bölünmez birimlerden oluştuğunu öne sürdü. Romalı şair Lucretius bu fikri kaydetti, bu yüzden daha sonra değerlendirilmek üzere Karanlık Çağlar boyunca hayatta kaldı.
Dalton'un Atom Teorisi
Bilimin atomların varlığına dair somut kanıtlar sunması 18. yüzyılın sonuna kadar sürdü. 1789'da Antoine Lavoisier, bir reaksiyonun ürünlerinin kütlesinin reaktanların kütlesi ile aynı olduğunu belirten kütlenin korunumu yasasını formüle etti. On yıl sonra, Joseph Louis Proust, bir bileşikteki element kütlelerinin her zaman aynı oranda meydana geldiğini belirten belirli oranlar yasasını önerdi.
Bu teoriler atomlara atıfta bulunmadı, ancak John Dalton, bir bileşikteki elementlerin kütle oranlarının küçük tam sayılar olduğunu belirten çoklu oranlar yasasını geliştirmek için atomlar üzerine inşa etti. Dalton'un çoklu oranlar yasası deneysel verilerden alınmıştır. Her kimyasal elementin, herhangi bir kimyasal yolla yok edilemeyen tek bir atom türünden oluştuğunu öne sürdü. Sözlü sunumu ( 1803 ) ve yayını ( 1805 ) bilimsel atom teorisinin başlangıcı oldu.
1811'de Amedeo Avogadro, eşit sıcaklık ve basınçta eşit hacimde gazların aynı sayıda parçacık içerdiğini öne sürdüğünde Dalton'un teorisiyle ilgili bir sorunu düzeltti. Avogadro yasası, elementlerin atom kütlelerini doğru bir şekilde tahmin etmeyi mümkün kıldı ve atomlar ile moleküller arasında net bir ayrım yaptı.
Atom teorisine bir diğer önemli katkı, 1827'de, suda yüzen toz parçacıklarının bilinen bir sebep olmadan rastgele hareket ettiğini fark eden botanikçi Robert Brown tarafından yapıldı. 1905'te Albert Einstein, Brown hareketinin su moleküllerinin hareketinden kaynaklandığını öne sürdü. Model ve 1908'de Jean Perrin tarafından doğrulanması, atom teorisini ve parçacık teorisini destekledi.
Erikli Puding Modeli ve Rutherford Modeli
Bu noktaya kadar, atomların maddenin en küçük birimleri olduğuna inanılıyordu. 1897'de J.J. Thomson elektronu keşfetti. Atomların bölünebileceğine inanıyordu. Elektron negatif bir yük taşıdığı için, elektronların elektriksel olarak nötr bir atom elde etmek için pozitif yüklü bir kütleye gömüldüğü atomun bir erik pudingi modelini önerdi.
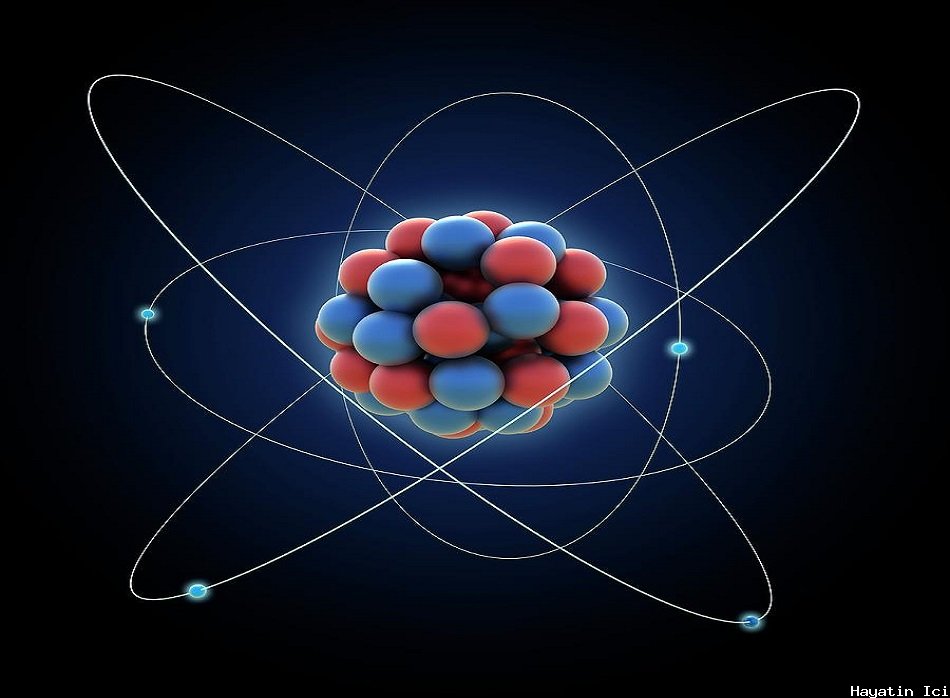
Thomson'ın öğrencilerinden biri olan Ernest Rutherford, 1909'da erik pudingi modelini çürüttü. Rutherford, bir atomun pozitif yükünün ve kütlesinin çoğunun bir atomun merkezinde veya çekirdeğinde olduğunu buldu. Elektronların küçük, pozitif yüklü bir çekirdeğin yörüngesinde döndüğü bir gezegen modeli tanımladı.
Bohr Atom Modeli
Rutherford doğru yoldaydı, ancak modeli atomların emisyon ve absorpsiyon spektrumlarını ya da elektronların neden çekirdeğe çarpmadığını açıklayamadı. 1913'te Niels Bohr, elektronların çekirdeğin yörüngesinde yalnızca çekirdekten belirli mesafelerde döndüğünü belirten Bohr modelini önerdi. Modeline göre, elektronlar çekirdeğe giremezdi, ancak enerji seviyeleri arasında kuantum sıçramaları yapabilirdi.
Kuantum Atom Teorisi
Bohr'un modeli, hidrojenin spektral çizgilerini açıkladı, ancak çoklu elektronlu atomların davranışına uzanmadı. Birkaç keşif, atomların anlaşılmasını genişletti. 1913'te Frederick Soddy, farklı sayıda nötron içeren bir elementin atomunun formları olan izotopları tanımladı. Nötronlar 1932'de keşfedildi.
Louis de Broglie, Erwin Schrödinger'in Schrödinger denklemini ( 1926 ) kullanarak tanımladığı hareketli parçacıkların dalga benzeri bir davranışını önerdi. Bu da, bir elektronun hem konumunu hem de momentumunu aynı anda bilmenin mümkün olmadığını belirten Werner Heisenberg'in belirsizlik ilkesine ( 1927 ) yol açtı.
Kuantum mekaniği, atomların daha küçük parçacıklardan oluştuğu bir atom teorisine yol açtı. Elektron potansiyel olarak atomun herhangi bir yerinde bulunabilir, ancak atomik bir yörüngede veya enerji seviyesinde en büyük olasılıkla bulunur. Rutherford'un modelinin dairesel yörüngelerinden ziyade, modern atom teorisi küresel, dambıl şeklinde vb. olabilen yörüngeleri tanımlar. Çok sayıda elektrona sahip atomlar için, parçacıklar ışık hızının çok altında hareket ettiği için göreli etkiler devreye girer.
Modern bilim adamları, protonları, nötronları ve elektronları oluşturan daha küçük parçacıklar buldular, ancak atom kimyasal yollarla bölünemeyen en küçük madde birimi olmaya devam ediyor.








:max_bytes(150000):strip_icc():format(webp)/GettyImages-510481524-7a3ebe67c7264b55a03949c06710befd.jpg)
:max_bytes(150000):strip_icc():format(webp)/GettyImages-515042427-023e68aa28af49639d67de5d8fafa252.jpg)
:max_bytes(150000):strip_icc():format(webp)/GettyImages-713783177-40dca734926a4781a4aab0fa7dbc1323.jpg)
:max_bytes(150000):strip_icc():format(webp)/GettyImages-1157225833-01064c770b904b23bb07df6eec68f35d.jpg)
:max_bytes(150000):strip_icc():format(webp)/GettyImages-845813912-fd50c340e6dd4b7f9fd639ca80a0ebd7.jpg)